-
D5b07 요약 '수소결합(HydrogenBond) https://infos.tistory.com/7141' 물(H₂O)은 전기 음성도가 높은 산소(O)와, 전기 음성도가 낮은 수소(H)가 공유결합으로 이어져 있다. 공유 전자쌍은 전기 음성도가 높은 O쪽으로 치우처져 있다. 이로 인해 O에 부분음전하, H에 부분 양전하가 나타난다. 양전하와 음전하는 결합하므로, 부분음전하인 O가 2개 있다면, 사이에 부분양전하인 H를 두면 두O는 서로 끌어당긴다.
수소 결합은 분자 간에 작용하는 인력(Intermolecular Force) 중 가장 강력한 힘을 말한다. 이는 이온 결합이나 공유 결합과 같은 원자 간의 화학 결합은 아니지만, 그 세기가 매우 강하여 '결합'이라고 불린다.
수소 결합의 원리
수소 결합은 다음과 같은 조건을 갖춘 분자들 사이에서 발생한다.
주개 (Donor): 전기음성도(Electronegativity)가 매우 큰 원자, 즉 F (플루오린), O (산소), N (질소) 중 하나에 수소(H) 원자가 공유 결합으로 붙어 있을 때. 이때 F, O, N은 전자를 강력하게 끌어당기므로, 수소 원자는 전자를 잃고 '부분적인 양전하 (delta+)를 띠게 된다.
받개 (Acceptor): 인접한 다른 분자에 있는 F, O, N 원자의 비공유 전자쌍이 부분적인 양전하를 띠는 수소 원자를 강하게 정전기적 인력으로 끌어당긴다.
이 정전기적 인력이 바로 수소 결합이다.F, O, N - H^delta+ ... :F, :O, :N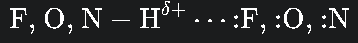
수소 결합의 특징
수소 결합을 하는 물질은 그렇지 않은 물질에 비해 매우 특이하고 중요한 성질들을 가진다.
특성 이유 높은 끓는점/녹는점 분자 간 인력이 강하기 때문에 액체를 기체로, 고체를 액체로 바꾸는 데 많은 에너지가 필요합니다. (물(H_2O)이 상온에서 액체인 주된 이유) 높은 비열/기화열 분자들을 떼어내거나 분자 운동성을 높이는 데 많은 에너지가 필요합니다. 높은 표면 장력 분자 간 응집력이 강력하여 표면적을 최소화하려는 힘이 큽니다. 얼음의 밀도 (물보다 작음) 물이 얼 때 수소 결합이 육각 고리 모양의 안정된 구조를 형성하며 빈 공간이 생기기 때문에 부피가 팽창하고 밀도가 작아집니다. 우수한 용매 물은 극성 분자나 이온 결합 화합물과 수소 결합 또는 강한 정전기적 인력을 형성하여 잘 녹입니다. 중요한 예시
수소 결합은 자연계와 생명 현상에 필수적이다.
물 (H₂O): 지구상의 액체 상태 물의 존재와 모든 특성의 근원.
DNA 이중 나선: DNA의 두 가닥(A-T, G-C 염기쌍)을 연결하여 이중 나선 구조를 유지하는 핵심적인 힘이다.
단백질 2차 구조: 단백질이 나선형(알파-나선)이나 병풍형(베타-병풍) 등의 입체 구조를 형성하는 데 중요한 역할을 한다.물 (H₂O)
'물 (H₂O)의 부분 전하 https://infos.tistory.com/7143' 물(H2O)은 분자 내에서 산소(O)와 수소(H) 원자 사이에 전자 분포가 비대칭적으로 나뉘어, 산소는 음전하(δ-)를, 수소는 양전하(δ+)를 띈다.
물의 특성 4가지(비열, 용해, 표면장력, 밀도)

물의 화확적 특성으로 인해 '수소결합'을 한다 물(H₂O)은 전기 음성도가 높은 산소와, 전기 음성도가 낮은 수소가 공유결합으로 이어져 있다. 이때 공유 전자쌍은 전기 음성도가 높은 산소쪽으로 치우처져 있다. 이로 인해 O에 부분 음전하, H에 부분 양전하가 나타난다.
양전하와 음전하는 결합하므로, 두 부분음전하인 O를 사이에두고 부분양전하인 H가 있어서 서로 끌어당긴다.'화학' 카테고리의 다른 글
표면장력 소금(NaCl, 나트륨 이온) (0) 2025.11.08 반데르발스 힘(van der Waals force) (0) 2025.11.07 물 (H₂O)의 부분 전하 (0) 2025.11.07 모세관력 (Capillary Force) (0) 2025.11.07 Na_2CO_3(탄산나트륨) pH와 Ec영향 (0) 2025.11.07 Na2CO3(탄산나트륨) (0) 2025.11.07 CEC(Cation Exchange Capacity, 양이온 치환 용량) (0) 2025.10.10 Ec와 토양 토질 (0) 2025.10.10